Valencias en la Tabla Periódica: Explorando la Importancia de los Elementos

INDICE
La tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite organizar y comprender la gran variedad de elementos que existen en el universo. Uno de los conceptos clave en la tabla periódica son las valencias, que determinan la capacidad de un átomo para formar enlaces químicos con otros átomos.
En este artículo, exploraremos la importancia de las valencias en la tabla periódica y cómo influyen en las propiedades y comportamiento de los elementos. Además, analizaremos algunos ejemplos de elementos con diferentes valencias y su relevancia en la industria y la vida cotidiana.

¿Qué son las valencias?
Las valencias tabla periódica son la capacidad de un átomo para combinar y formar enlaces químicos con otros átomos. Estas valencias están determinadas por la distribución de electrones en los niveles de energía del átomo. Los electrones en la capa más externa, conocida como capa de valencia, son los responsables de las interacciones químicas.
La tabla periódica nos proporciona información sobre las valencias de los elementos. Algunos elementos tienen una valencia fija, lo que significa que siempre forman un número específico de enlaces químicos. Por ejemplo, el hidrógeno tiene una valencia de +1, lo que significa que siempre forma un enlace con un átomo de otro elemento.
Por otro lado, algunos elementos tienen valencias variables, lo que significa que pueden formar diferentes números de enlaces químicos. Por ejemplo, el hierro puede tener una valencia de +2 o +3, lo que le permite formar diferentes compuestos químicos.

Importancia de las valencias
Las valencias son fundamentales en la formación de compuestos químicos. Los enlaces químicos se forman cuando los átomos comparten o transfieren electrones de su capa de valencia. Estos enlaces son responsables de las propiedades y comportamiento de las sustancias.
Por ejemplo

¿Qué son las valencias en la tabla periódica?
Las valencias en la tabla periódica son una propiedad de los elementos químicos que determina su capacidad para formar enlaces químicos con otros elementos. La valencia de un elemento se refiere al número de electrones que puede ganar, perder o compartir para alcanzar una configuración electrónica estable.
Las valencias se representan mediante números positivos o negativos, y se indican en la tabla periódica mediante números romanos o números arábigos. Los elementos con valencias positivas tienden a perder electrones y formar cationes, mientras que los elementos con valencias negativas tienden a ganar electrones y formar aniones.
Las valencias son fundamentales para comprender cómo los elementos se combinan entre sí para formar compuestos químicos. Al conocer las valencias de los elementos, los químicos pueden predecir qué tipo de enlaces se formarán y cómo se comportarán los compuestos en diferentes reacciones químicas.
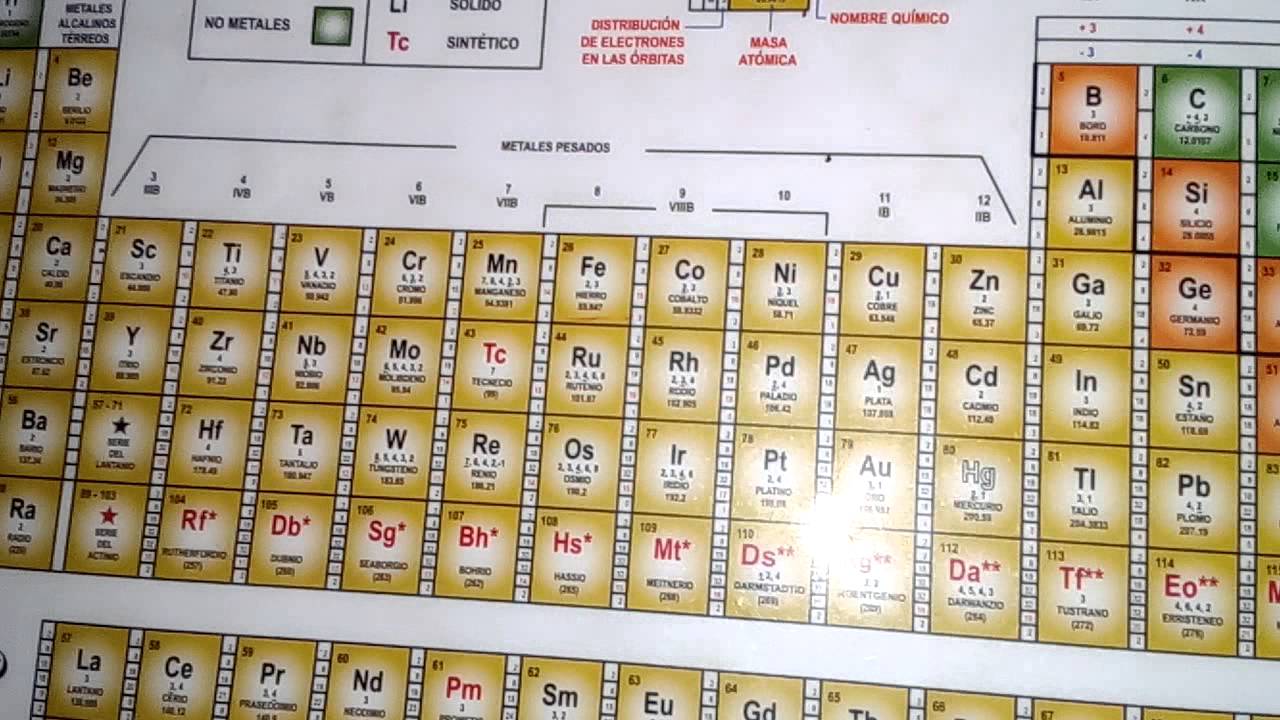
Importancia de conocer las valencias de los elementos
Las valencias de los elementos son fundamentales para comprender cómo se combinan y reaccionan entre sí. Estas valencias determinan la capacidad de un átomo para formar enlaces químicos y participar en reacciones químicas. Conocer las valencias de los elementos es esencial para entender la estructura y las propiedades de las sustancias químicas.
Las valencias de los elementos también son importantes en la formulación de compuestos químicos. Al conocer las valencias de los elementos, podemos predecir cómo se combinarán para formar compuestos estables. Esto es especialmente útil en la industria farmacéutica y en la fabricación de productos químicos, donde la capacidad de predecir y controlar las reacciones químicas es crucial.
Además, el conocimiento de las valencias de los elementos es esencial en la química analítica. La determinación de las valencias de los elementos en una muestra puede proporcionar información sobre su composición y estructura. Esto es especialmente útil en la identificación de sustancias desconocidas y en el análisis de muestras en diversos campos, como la medicina forense y la investigación científica.
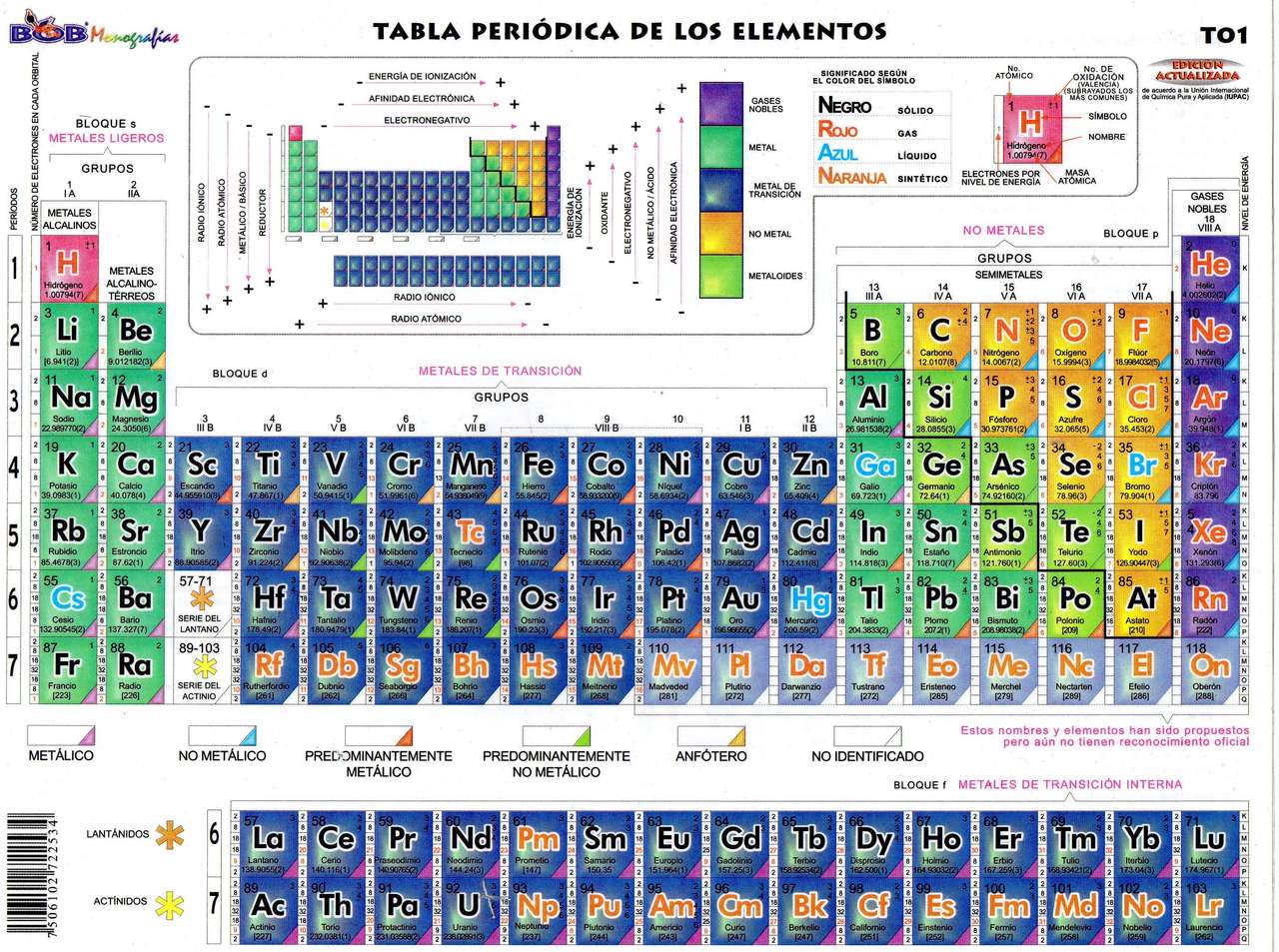
¿Cómo se determinan las valencias de los elementos?
Las valencias de los elementos se determinan a través de su configuración electrónica, es decir, la distribución de los electrones en los diferentes niveles y subniveles de energía. La configuración electrónica de un elemento determina la cantidad de electrones que tiene en su capa de valencia, que es la capa más externa del átomo.
La capa de valencia es la responsable de las propiedades químicas de un elemento, ya que los electrones de esta capa participan en las reacciones químicas y en la formación de enlaces con otros átomos. La cantidad de electrones en la capa de valencia determina la valencia del elemento, que es la capacidad que tiene un átomo de un elemento para combinarse con otros átomos y formar compuestos.
Por ejemplo, el sodio tiene una configuración electrónica de 2-8-1, lo que significa que tiene un electrón en su capa de valencia. Esto le confiere una valencia de +1, ya que tiende a perder ese electrón para adquirir una configuración electrónica estable de 2-8. Por otro lado, el cloro tiene una configuración electrónica de 2-8-7, lo que indica que tiene 7 electrones en su capa de valencia. Esto le confiere una valencia de -1, ya que tiende a ganar un electrón para adquirir una configuración electrónica estable de 2-8-8.
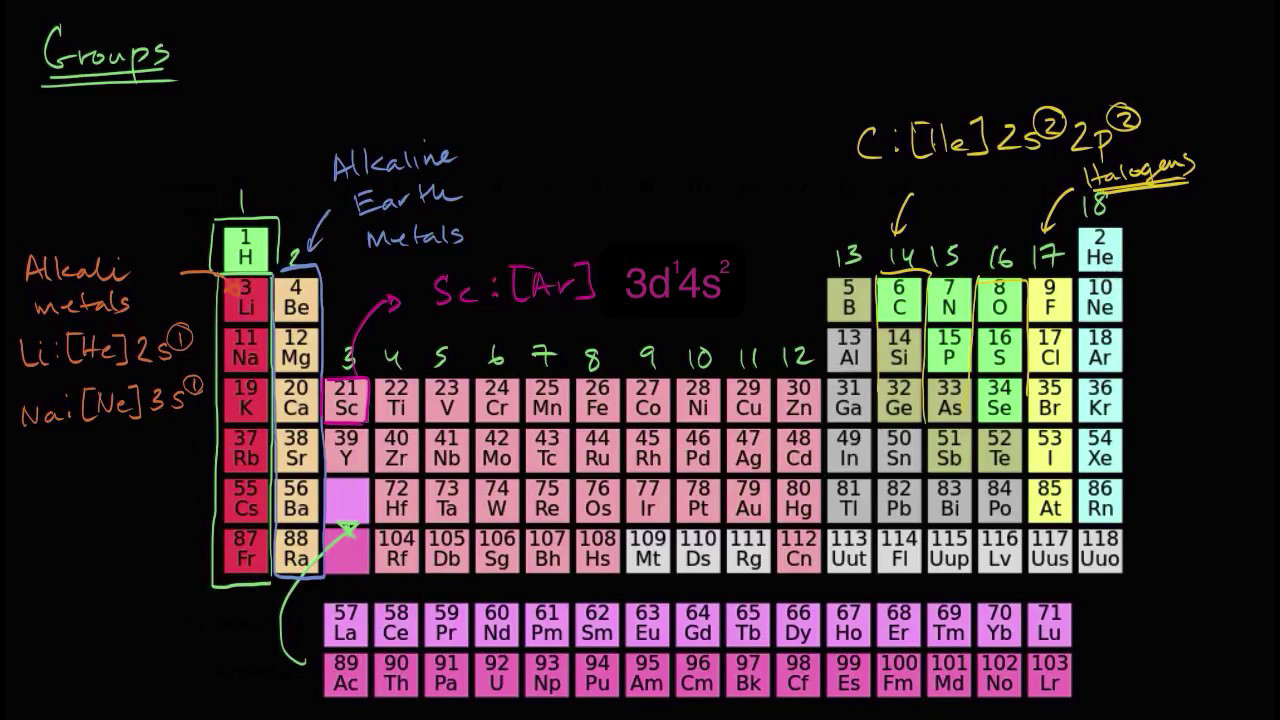
Valencias de los elementos más comunes
Las valencias de los elementos químicos son una propiedad fundamental que determina su capacidad para formar compuestos químicos. Estas valencias se refieren a la capacidad de un átomo para ganar, perder o compartir electrones con otros átomos.
En la tabla periódica, podemos encontrar una gran variedad de elementos con diferentes valencias. Algunos de los elementos más comunes y sus valencias son:
- Hidrógeno (H): Su valencia es +1 cuando forma compuestos con metales y -1 cuando forma compuestos con no metales.
- Oxígeno (O): Su valencia es -2 cuando forma compuestos con otros elementos.
- Sodio (Na): Su valencia es +1 cuando forma compuestos.
- Cloro (Cl): Su valencia es -1 cuando forma compuestos.
- Calcio (Ca): Su valencia es +2 cuando forma compuestos.
- Hierro (Fe): Su valencia puede variar, siendo +2 o +3 las más comunes.
Estas valencias son importantes para comprender cómo los elementos se combinan entre sí para formar compuestos químicos. Además, las valencias también nos permiten predecir la fórmula química de un compuesto y entender su comportamiento químico.

Valencia del hidrógeno
El hidrógeno es el elemento más ligero y abundante en el universo, y su valencia es única. Aunque se clasifica como un no metal, su valencia puede variar dependiendo de los elementos con los que se combine. En su forma más común, el hidrógeno tiene una valencia de +1, lo que significa que tiende a perder un electrón para formar un ion positivo. Sin embargo, también puede tener una valencia de -1 cuando se combina con elementos más electronegativos, como el oxígeno o el flúor. Esta capacidad de cambiar su valencia hace que el hidrógeno sea un elemento muy versátil y participe en una amplia variedad de reacciones químicas.
Cuando el hidrógeno forma un enlace covalente con otro elemento, comparte su único electrón con el electrón del otro elemento. Esto le permite formar compuestos estables, como el agua (H2O) o el metano (CH4). En estos compuestos, el hidrógeno tiene una valencia de +1, ya que ha perdido su único electrón y ha adquirido una carga positiva. Sin embargo, cuando el hidrógeno se combina con elementos más electronegativos, como el oxígeno en el agua, adquiere una carga negativa y su valencia se convierte en -1.
La valencia del hidrógeno es fundamental en muchas reacciones químicas y procesos biológicos. Por ejemplo, en la fotosíntesis, el hidrógeno se combina con el dióxido de carbono para formar glucosa, liberando oxígeno como subproducto. Además, el hidrógeno desempeña un papel crucial en la producción de energía en las células, ya que participa en la síntesis de ATP, la molécula que almacena y libera energía. En resumen, la valencia del hidrógeno es esencial para comprender su comportamiento químico y su importancia en la naturaleza.


